分子変換プロセスを触媒で刷新し
新分子創製に挑戦
化学の原点は「モノづくり」にあります。有機化学は欲しいものだけを作る選択的な物質変換に加え、物質変換に伴う廃棄物の削減を実現する環境に配慮した分子変換プロセスの開発が求められています。
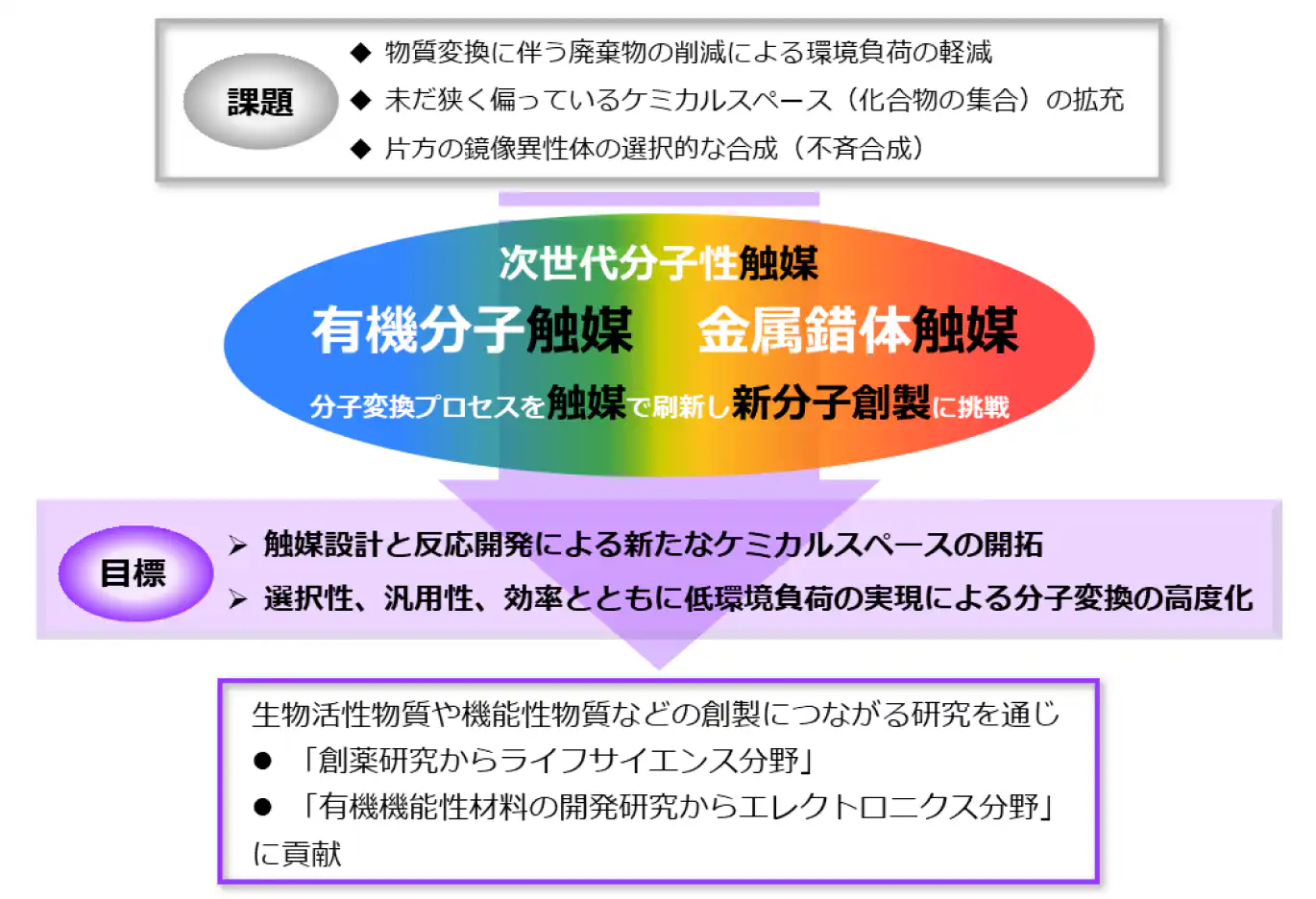
これまで数多くの化学者が分子を合成するための化学反応を開発してきましたが、その一方で、例えば医薬品の候補となる低分子化合物は1060種類を超えると推定されています。しかし、実際に合成された分子のケミカルスペース(化合物の集合)は未だ狭く偏っており、ケミカルスペースのさらなる拡充が必要とされています。こうした新分子創出とともに、片方の鏡像異性体(エナンチオマー)を選択的に合成(不斉合成)することは医薬品や農薬などの薬効を示す生物活性物質の製造において、今や不可欠な方法論となっています。選択的な分子変換を環境に配慮しつつ実現することも分子変換プロセスの高度化に求められる重要課題の一つとなっています。
私たちの研究室では有機分子や遷移金属錯体の特性を生かした次世代分子性触媒を創製することで選択性、汎用性、効率を追求するとともに、新たな分子群の創出に応える新しい分子変換法の開発を行っています。触媒設計と反応開発を基軸に新たなケミカルスペースの開拓、分子変換の高度化や低環境負荷の実現を目指しています。生物活性物質や機能性物質などの創製につながる研究を通じて、「創薬研究からライフサイエンス分野」や「有機機能性材料の開発研究からエレクトロニクス分野」に貢献することを最終的な目標として下記に示す主に4つのテーマに取り組んでいます。
a) 基質認識型キラルブレンステッド酸触媒の
設計開発と生物活性物質合成への展開
a-1) キラルブレンステッド酸触媒の設計開発と触媒反応系の開拓
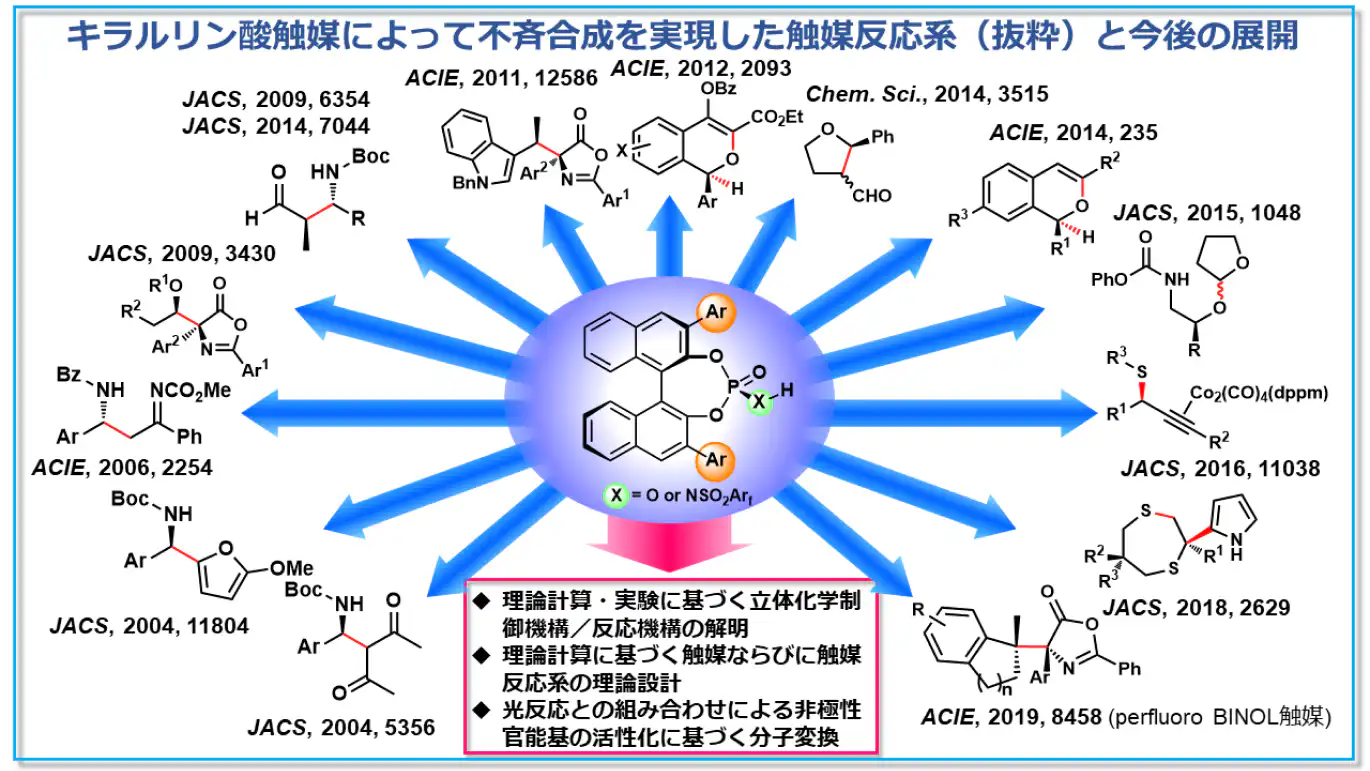
ブレンステッド酸は、様々な有機合成反応において反応基質を活性化することができる代表的な触媒です。私たちの研究室では、基質の活性化に加えて、水素結合という相互作用によって基質の認識を可能とする、キラルブレンステッド酸触媒の設計·開発を行ってきました。特に、独自に開発したキラルリン酸触媒を用いて、片方のエナンチオマーを選択的に得る不斉合成を、多彩な触媒反応系で実現しています。これらの豊富な経験と知見を活かし、実験と理論計算を積極的に組み合わせることで、立体化学制御機構を明らかにするとともに、高度な立体化学制御を実現する触媒や触媒反応系を理論計算に基づいて設計開発することにも取り組んでいます。こうした極性官能基の活性化を起点とする酸触媒としての活用法の他に、キラルブレンステッド酸触媒と光反応を組み合わせることで、これまで反応に用いることができなかった非極性官能基の活性化にも取り組んでいます。既存の方法では成し得なかった分子変換を実現することで、酸触媒としての枠組みを超えた触媒反応系の開拓を目指しています。
a-2) キラルリン酸を利用した天然有機化合物や医薬品の効率的合成法の開発
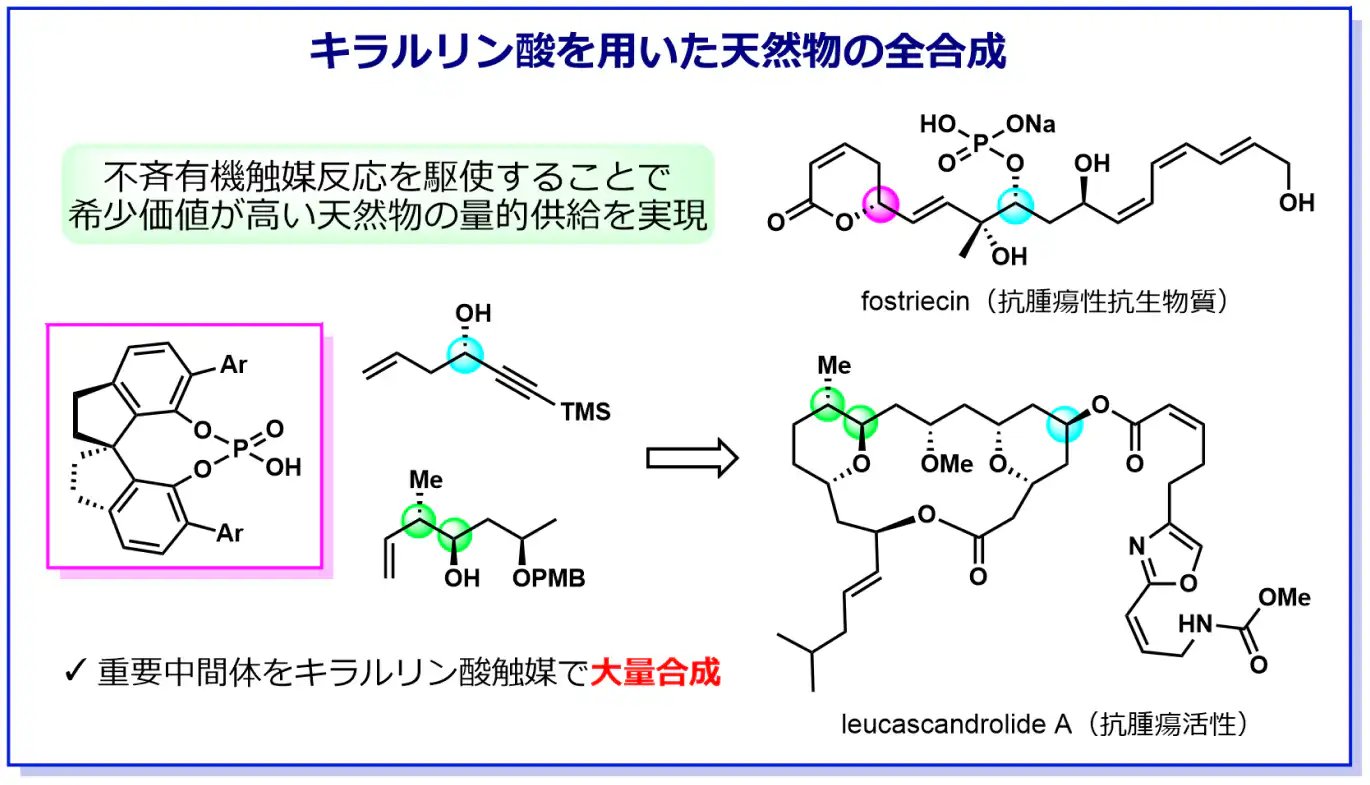
天然有機化合物(天然物)は多様な生物活性を有する物質の宝庫であり、人類は有史以来、様々な天然物を薬や毒として利用してきました。また、近年では天然物の構造をベースとした医薬品の開発も盛んに行われており、天然物を超える活性を持つ化合物が数多く生み出されています。一方で、天然からごく少量しか得る事が出来ず、その作用機序や医学·生物学的研究が進んでいない天然物も多数存在しています。そこで、これまで研究室で培ってきたキラルリン酸触媒反応の知見を活かし、重要な天然物や医薬品を効率的に合成するプロセスの確立に取り組んでいます。現在までに、下記に示すfostriecinを過去最短工程、及びleucascandrolide Aを過去最高収率で合成することに成功しています。この合成ルートにはキラルリン酸触媒を用いた不斉反応が効果的に組み込まれており、これまで研究室で開発してきた触媒が全合成の強力なツールとなることを示しています。環境負荷が少なくかつ大量供給可能な合成手法を開発することで、有機合成化学のみならず創薬化学分野への貢献を目指しています。
b) ブレンステッド塩基を用いた
触媒的分子変換反応の設計開発
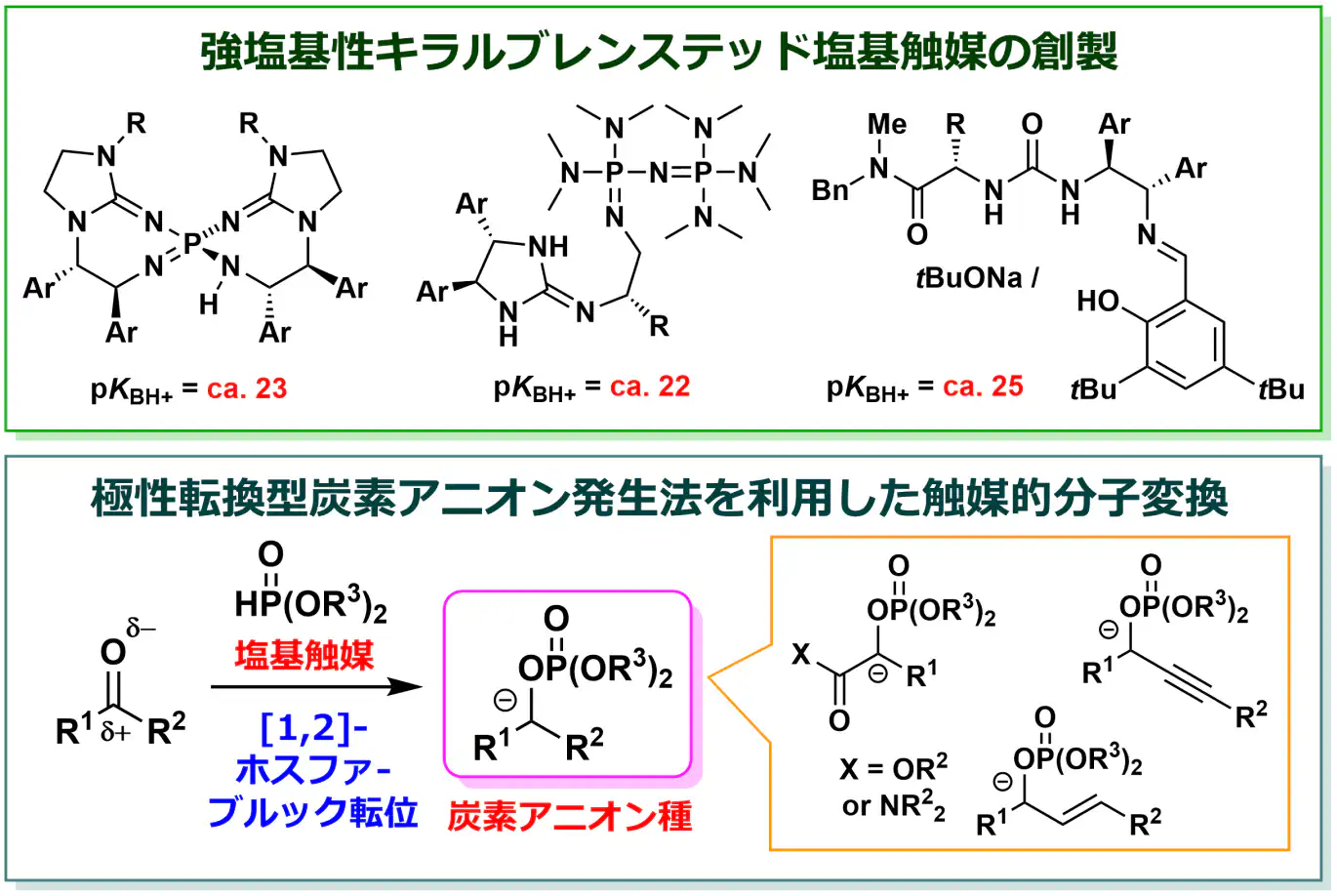
私たちの研究室では、環境調和型の触媒として注目を集めている有機分子触媒(低分子有機化合物からなる触媒)の一つであるブレンステッド塩基触媒に着目し、「高活性なキラルブレンステッド塩基触媒の創製」と「高度な触媒的分子変換反応の設計·開発」に取り組んでいます。例えば、従来の触媒に比べて格段に高い塩基性を有するキラルブレンステッド塩基を開発し、これまで反応に用いることが難しかった様々な化合物を用いた不斉分子変換反応を開発しています。また、様々なアニオンを効果的に活用する触媒反応系を設計し、従来の有機合成手法では合成ができない多様な置換基が位置選択的に導入された複素環化合物の合成法を開発しています。このように、これまでにない高効率かつ高選択的な分子変換を実現することで、新たな医農薬品や有機機能材料の元となる多様な有機化合物を合成するための有用な精密有機合成ツールの提供を目指しています。加えて、従来の有機合成手法では合成が困難な非天然型アミノ酸およびその類縁体、複素環化合物の合成法を確立することでケミカルスペース(化合物の集合)を拡張し、創薬研究をはじめとするライフサイエンス研究の加速への貢献も目指しています。
2016.5.25 東北大学理学研究科ホームページ掲載
研究成果 「新たな触媒が拓く新たな有機合成 ~"最強"の不斉有機塩基触媒による反応開発~」
2018.8.9 東北大学理学部化学科ホームページ掲載
最新の研究成果「“最強”の触媒による新たな有機合成~不斉有機超強塩基触媒を用いた分子変換反応の設計·開発~」
2022.3.24 東北大学理学部化学科ホームページ掲載
最新の研究成果「環骨格を開いて閉じる~フッ素置換ピぺリジンの新たな合成~」
c) 金属触媒を利用した骨格転位反応の開発
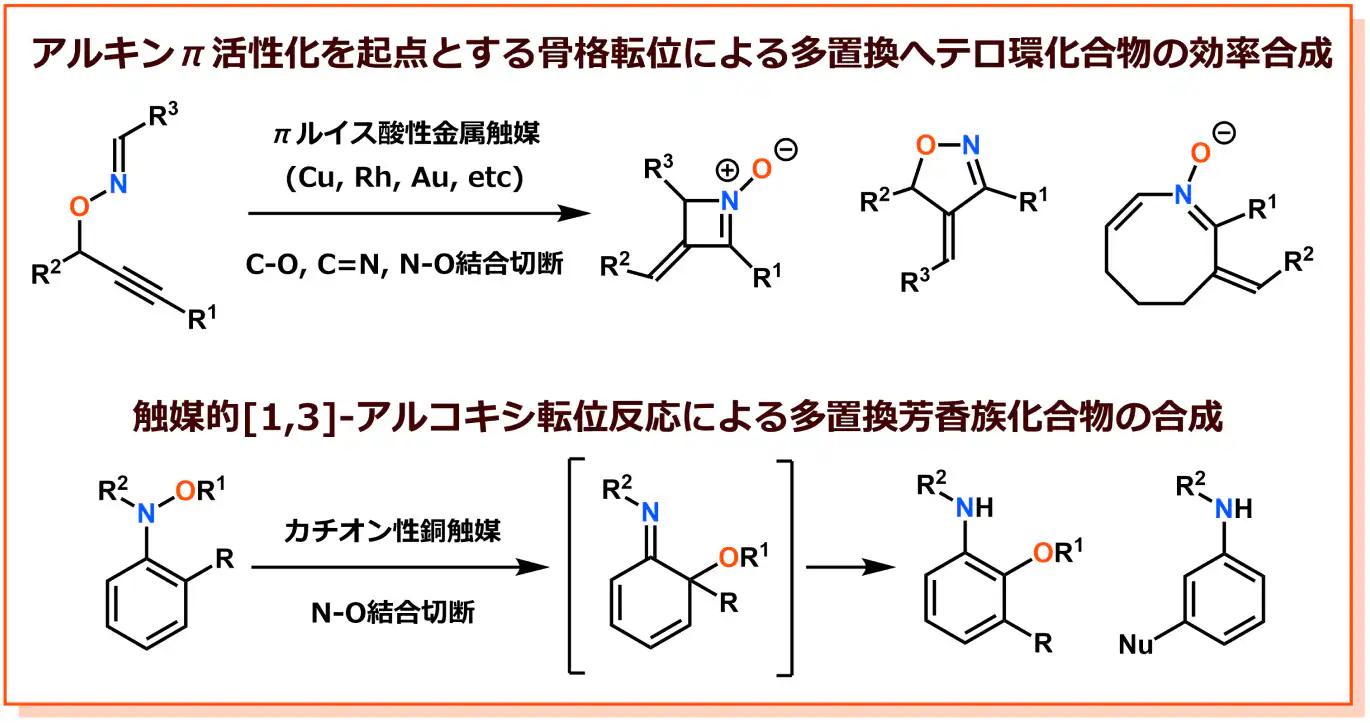
新しい分子を合成する=ケミカルスペースのさらなる拡大という普遍的な問いに対し、私たちは「触媒的骨格転位」という戦略に基づく研究を展開しています。骨格転位反応とは、分子骨格を形成する共有結合(炭素-炭素、炭素-酸素、窒素-酸素など)の切断を経て出発物質の構造異性体を合成する化学反応のことです。特に、弱い共有結合の切断を推進力とすることにより、ひずんだ分子骨格など従来法では合成できなかった分子を作り出すことが期待できます。さらに、反応前後で原子をロスすることない原子効率的なプロセスであるため、現代の化学に要請される低環境負荷型分子合成法とも位置づけられます。私たちはこれまでに独自の基質設計と丹念な金属触媒の探索によりユニークな骨格転位反応を開発し、従来法では困難であった分子の合成を実現してきました。例えば、世界に先駆けO-プロパルギルオキシム化合物のアルキンの活性化を起点とする触媒的骨格転位反応によりこれまでに合成例のない多様はヘテロ環化合物の合成法を開発しました。さらに、N-アルコキシアニリンの[1,3]-アルコキシ転位反応を触媒的に進行させるカチオン性銅触媒系を見出し、新たな多置換アニリン誘導体の合成法を開発しました。ヘテロ環化合物や多置換芳香族化合物は医薬品として幅広く利用されていることから、新規触媒的骨格転位反応の開発は創薬に貢献できるものと考えます。触媒的転位反応による新分子創製は大きな可能性を秘めており、さらなる基質のデザインと触媒の深化による新反応·新手法の実現とともに、その背後にある化学結合の反応性と触媒作用の原理の解明を目指しています。
2018.6.26 東北大学理学研究科ホームページ掲載 プレスリリース「ドミノ転位反応で新規アニリンの効率的な合成法の開発 新薬·新材料開発への応用を期待」
2020.5.7 東北大学理学部化学科ホームページに掲載 最新の研究成果「触媒的転位反応を鍵とするメタ置換アニリンの効率的合成法」(2020)
d) 新奇な機能性π電子分子の創出を目指した
新しい骨格構築反応の開発
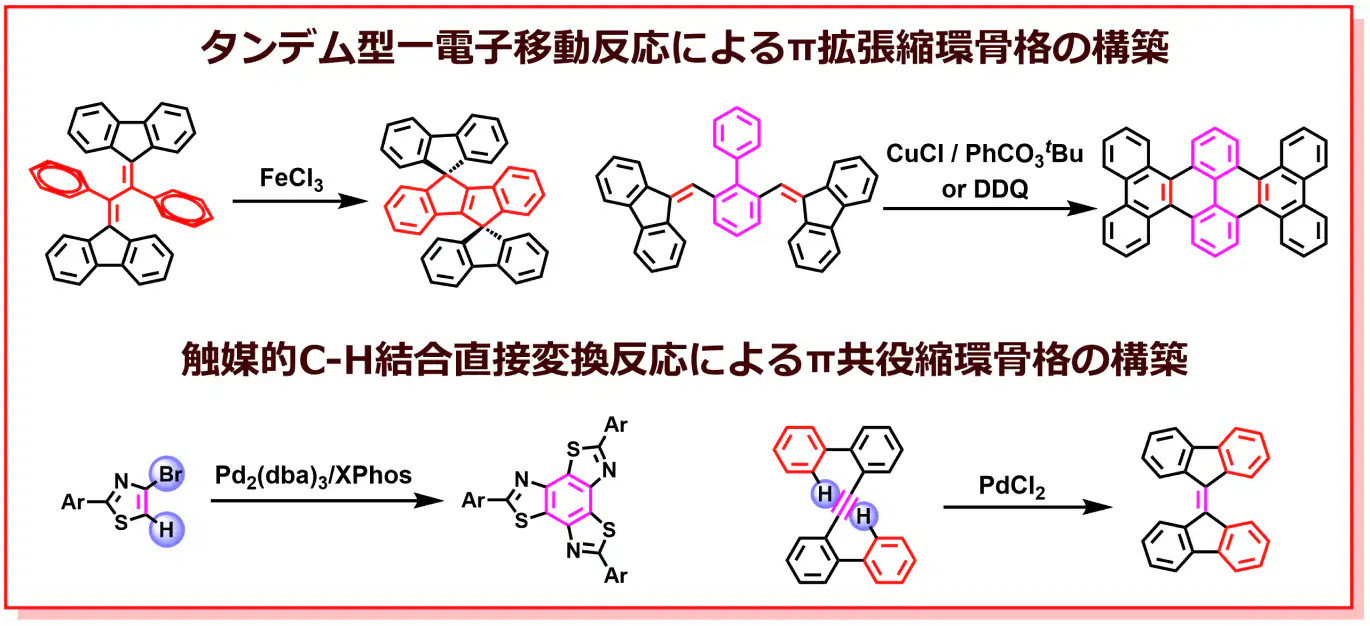
近年、有機トランジスタ、有機エレクトロルミネッセンス(EL)、有機薄膜太陽電池などの有機エレクトロニクスの急速な発展に伴い、新たなπ電子系光電子機能物質の開発研究の重要性は益々高まっています。特に、高度に拡張したπ共役縮環骨格において分子間相互作用が大きくなること、縮環形式や長さなどの僅かな違いによって特異な電子·光学的特性を示すことが知られています。従って、構造多様性と優れた光電子機能を備えたπ共役縮環化合物の設計および合成は光電子材料の更なる発展に極めて重要な研究課題となっています。私たちの研究室では、これまで新反応、新奇な構造、優れた発光および電荷輸送機能を有するπ拡張縮環骨格の構築を目的として、タンデム型一電子移動反応やC-H結合活性化反応などの革新的な遷移金属触媒反応の開発を行っています。これまで合成困難であった新しいπ電子系物質の設計·合成は有機エレクトロニクス分野に新たな機能物質群の提供と光電子機能性分子の設計に新たな方向性を明確に示すことが期待されます。
